アミロイドの脱凝集メカニズムを解明
アミロイド構造に依存した脱凝集機構が明らかに
おすすめ プレスリリース
細胞制御工学研究センターの田口英樹教授らのグループは、in vitro(試験管内)再構成系におけるアミロイドの脱凝集反応の確立に成功しました。
本研究成果は、これまで治療困難であった神経変性疾患の創薬開発に貢献するものと期待できます。
プリオンタンパク質のアミロイドの脱凝集機構には、タンパク質の恒常性の維持に関わるシャペロンタンパク質が関与していることが示唆されていますが、脱凝集の詳しい分子メカニズムは不明のままでした。
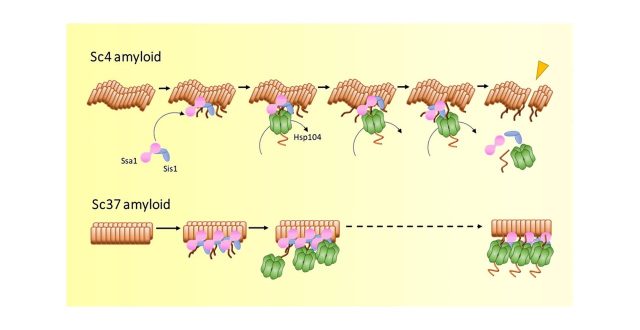
今回、共同研究グループは全反射照明蛍光顕微鏡を用いて、酵母のSup35プリオンタンパク質のアミロイド(Sc4アミロイド)に蛍光ラベルしたシャペロンタンパク質を加え、Sc4アミロイドが脱凝集する過程を調べました。その結果、脱凝集にはHsp104、Ssa1、Sis1の3つのシャペロンタンパク質が必要であることが分かりました。また、アミロイドにはSsa1とSis1が先に結合し、そこにHsp104が結合・解離を繰り返すことで、アミロイドが分断されることが分かりました。さらに、別の構造を持つSup35のSc37アミロイドでは、アミロイドが一様に脱凝集(溶解)されたため、脱凝集の様式が分断とは異なることも明らかになりました。
本研究は、科学雑誌『Nature Chemical Biology』(3月号)の掲載に先立ち、オンライン版(2月17日付:日本時間2月18日)に掲載されました。
詳しくはこちら
